Un método para modelar la descomposición de un electrolito de polímero durante el proceso de nucleación de litio en baterías de metal de litio
Figura 1. Diagrama de flujo para la simulación de un sistema de ánodo de litio-PEO. Los cálculos totales se realizaron en cuatro pasos. Primero, se realizó una simulación AIMD de 5 ps de SPE en la superficie del ánodo de Li. Luego, se agregaron 10 átomos de litio y se precalibraron durante 500 fs para encontrar posiciones iniciales plausibles para estos mientras se arreglaba el resto del sistema, y se realizaron simulaciones AIMD 3 ps más tarde. Esto imita a Li+ reducción durante el recubrimiento de litio. La adición y simulación de átomos de litio se repitieron dos veces más, para un total de 14 cálculos AIMD, agregando un total de 30 átomos de litio. La temperatura se fijó en 600 K durante el período de preequilibrio para acelerar la relajación de los átomos de litio añadidos. Después del preequilibrio de cada fase, el polímero y las tres capas superiores de la superficie del ánodo de Li se relajaron, la simulación AIMD del sistema de ánodo PEO-Li pudo continuar. Las cargas de electrones se calcularon utilizando el análisis de carga de Bader29Y3031. Se seleccionaron diez configuraciones en los últimos 500 fs cercanas al mínimo de energía para obtener la carga atómica en cada paso. Se distinguieron átomos de diferentes entornos químicos y se calcularon las cargas atómicas. La distribución de carga atómica para cada ambiente químico fue dada por una función Gaussiana.
Realice el cálculo general para predecir posibles componentes SEI.
La Figura S1 muestra el perfil de energía de simulación AIMD de PEO puro. Los componentes de PEO no sufrieron ninguna degradación durante la simulación AIMD de 10 ps y el sistema alcanzó un equilibrio térmico aparente dentro de 1 ps. Comprender el mecanismo de degradación de la PEO observado en mediciones XPS in situ anteriores26donde la energía de enlace se calibra utilizando el pico de 286,7 eV en C 1s Espectro de PEO Como referencia, realizamos simulaciones AIMD en cuatro fases, como se muestra en la Fig. 1. El diagrama de energía de PEO en un sistema de ánodo de litio durante el tiempo de simulación se muestra en la Fig. 2a. La primera fase (regiones amarillas) representa PEO en la superficie del ánodo de Li(100); La energía alcanza el equilibrio térmico aparente inmediatamente, lo que significa que la descomposición del PEO no ocurrió en estas escalas de tiempo. Después de simular 5 ps, simulamos el proceso de nucleación de Li en tres fases adicionales (regiones azul, verde y roja). Se agregaron diez átomos de litio adicionales a la configuración final de la etapa anterior. Se realizó un procedimiento de preequilibrio adicional y la fluctuación de energía se muestra en la Fig. S2. Para cada etapa de la nucleación de Li, el sistema alcanza un equilibrio térmico aparente dentro de la simulación AIMD 3 ps y la energía dentro de cada etapa disminuye, lo que significa que se ha producido la descomposición del PEO. Las simulaciones indican que la reducción y la deposición de Li degradan el PEO significativamente más que simplemente exponer el electrolito basado en PEO a la superficie de metal de litio.
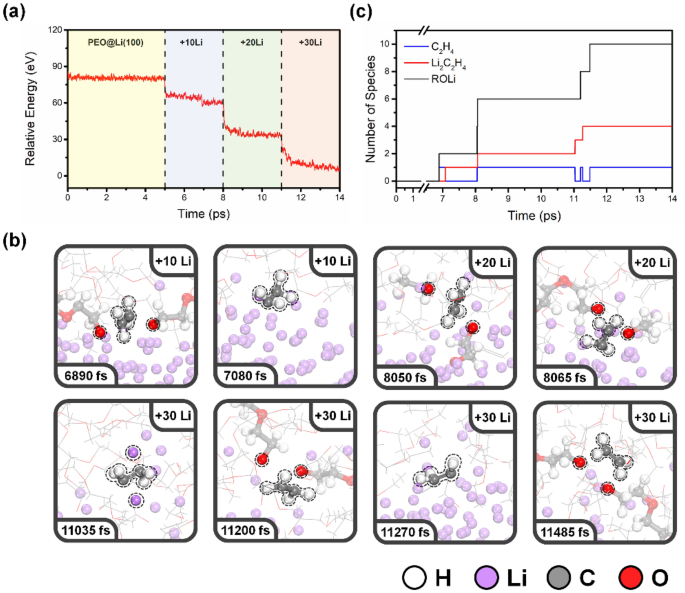
(a) Diagrama de energía durante el tiempo de simulación de PEO en la superficie del ánodo de Li(100) durante la nucleación de Li. (B) Capturas de pantalla de PEO en la superficie del ánodo Li(100) de simulaciones AIMD. (C) el número de productos de descomposición obtenidos durante las reacciones de descomposición de PEO en la superficie del ánodo de Li.
La Figura 2b muestra una serie de instantáneas en diferentes tiempos de simulación extraídas de la simulación AIMD. La primera reacción de descomposición del PEO se observa a 6890 fs, en la primera etapa de nucleación de Li. La primera cadena de PEO se hidrolizó, formando dos alcóxidos de litio, uno de los principales componentes SEI observados para la degradación de PEO en la superficie de Li25,26. Además, se puede formar una sola molécula de etileno mediante dos rendijas de enlace C-O a 7080 fs. La molécula de etileno altamente reactiva formada interactuó con la superficie de litio metálico y generó complejos de etileno de litio (Li2C2h4)32. Luego se observó una secuencia de reacciones de descomposición de PEO a 8050, 8065 y 11200 fs, y las moléculas de etileno resultantes posteriormente formaron Li2C2h4 a 11.035, 8065 y 11.270 fs, respectivamente. La última descomposición del PEO ocurrió a 11485 fs, donde la molécula de etileno quedó a la vista del sistema. s2 Hibridación hasta el final de la simulación AIMD. Todas las interacciones interfaciales y los tiempos aproximados de los eventos se resumen en la Tabla S1. Los productos de descomposición resultantes incluyen óxidos de litio (Rolli), moléculas de etileno (C2h4) y li2C2h4, y la formación de especies de degradación en la interfaz del ánodo PEO-Li. El número de estas especies se muestra en la Fig. 2c, en las que se encuentran los alcóxidos de litio y Li2C2h4 son los principales componentes de SEI. Las moléculas de etileno generalmente se forman como intermediarios, pero están presentes en presencia de Li0 directo a mi2C2h4. Es importante tener en cuenta que las simulaciones AIMD exploran cualitativamente los posibles productos de descomposición y los posibles mecanismos de reacción y proporcionan la sincronización relativa en lugar de absoluta de las interacciones.
La distribución de carga atómica de los átomos de oxígeno y carbono en el sistema de ánodo PEO y PEO-Li en diferentes etapas de la nucleación de Li se presentan en la Fig. 3a y c, respectivamente. Para los átomos de oxígeno, solo hay un entorno químico en el PEO puro, es decir, el oxígeno del éter (OC, ~−1.02|e|). Después de colocar PEO en la superficie del ánodo de Li, la distribución sigue siendo casi la misma, pero el centro del pico se desplaza ligeramente hacia valores más negativos (~ – 1,05 |e|), lo que se debe a los átomos de oxígeno. de la cadena de PEO que se adsorbe en la superficie del ánodo de litio. Esto hace que las cargas atómicas de los átomos de oxígeno se vuelvan más negativas. Esta menor pendiente también se observa en O 1s Espectro XPS de PEO, en el que se observó un cambio en la posición máxima de 532,7 a 532,6 eV a medida que se depositaba litio en la superficie de PEO. Se observa un pico adicional en el rango de -1,3 a -1,4 | mi | Esto indica la formación de una nueva especie, correspondiente al alcóxido de litio (ROLi), mientras que los átomos de oxígeno ganan densidad electrónica a partir del metal litio. Al mismo tiempo, un nuevo pico en el experimental O 1s El espectro XPS a 530,4 eV investiga la formación de especies de alcóxido de litio. La intensidad del pico de óxido de litio aumenta gradualmente después de los siguientes dos procesos de nucleación de litio en la simulación. Se presentan dos picos en el sistema PEO puro de átomos de carbono. El pico principal es ~ + 0.4 | mi | corresponde a los átomos de carbono del esqueleto del PEO (C–O), lo que también se observa para C1s Espectros XPS a 286,7 eV. El pequeño pico está en ~ – 0.1 | mi | Corresponde al final de la cadena PEO (–CH3), que tienen el mismo entorno químico que los hidrocarburos (C – C / C – H), y C 1 empíricos Señal de espectro XPS a 285,1 eV que corresponde a contaminación superficial con hidrocarburo en preparación de muestra. En la simulación, la concentración de –CH3 Los grupos son mucho más altos que sus contrapartes experimentales, por razones prácticas. Durante los procesos de nucleación de Li, se generaron dos nuevos picos a ~−0,1| mi | y ~ – 0,7 | mi | ; Los entornos químicos correspondientes son C2h4 guardián2C2h4 especie, respectivamente. Considerando la posición del pico análoga a (–CH3) y C2h4, es probable que se fusionen y aparezcan como un solo pico pero con un pequeño ensanchamiento, como se muestra por el crecimiento del pico CC/CH en la Fig. 3d. Literatura previa21,25 Muestra que la presencia de agua puede afectar la disolución del electrolito. Sin embargo, la ausencia de un pico de LiOH en la Fig. 3b muestra que el contenido de agua es insignificante, lo que puede atribuirse al estado de alto vacío en la medición XPS (~10– 10 mbar) y un experimento de deposición de litio (~10–8 mbar). Como se mencionó anteriormente, la distribución de carga atómica es un descriptor efectivo para comprender los picos en el espectro XPS.
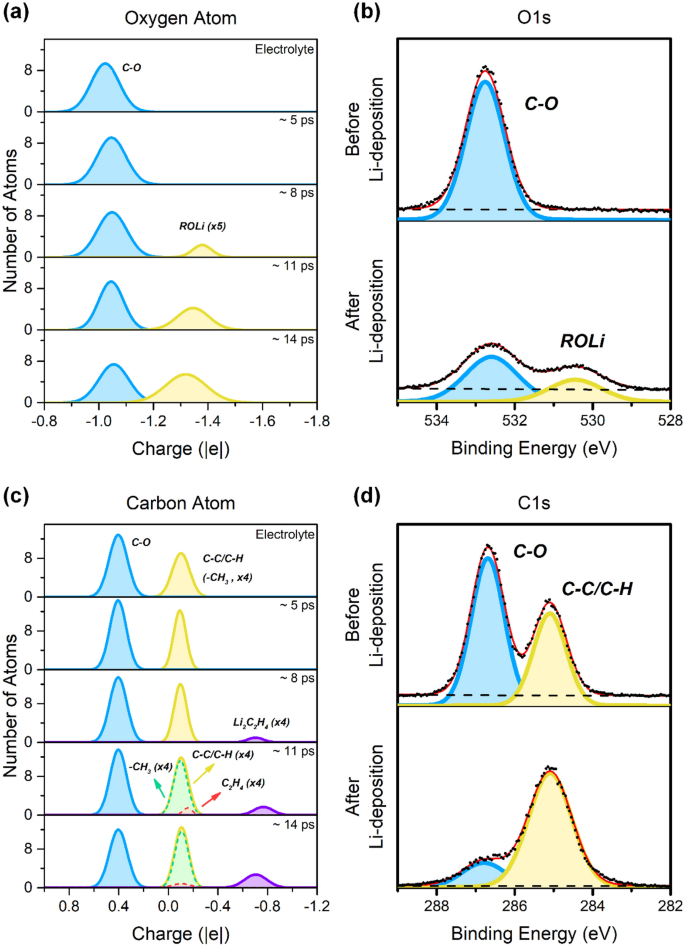
La distribución de carga atómica de (a) oxígeno y (C) los átomos de carbono en PEO puro y en la superficie del ánodo de Li(100) se encuentran en diferentes etapas de nucleación de Li. referencia (B) Q1s Y (DrC 1s Espectros XPS de PEO puro antes y después de la nucleación de Li, utilizando datos publicados previamente en la ref.26.
Para explorar el papel adicional de Li en detalle, colocamos el oligómero de PEO en una capa de vacío y lo adsorbimos en una superficie de Li(100). También adsorbimos un compuesto de PEO-Li en una superficie de Li(100), que incluye 5 capas de Li con una supercélula de 5 × 5. La Figura S3 muestra las estructuras optimizadas de PEO antes y después de la adsorción en la superficie de Li(100) y del compuesto de PEO-Li adsorbido en la superficie de Li(100). La densidad de estados prevista correspondiente (PDOS) para PEO en cada sistema se muestra en la Figura S4. Después de que el PEO se adsorbe en la superficie de Li, su banda de conducción, que está por encima del nivel de Fermi, se hibrida mucho con la superficie de Li y se ensancha al nivel de Fermi, lo que explica la transferencia de electrones desde la superficie de Li al PEO. Además, la banda de conducción del complejo PEO-Li se desplazó aún más cuando se adsorbió en la superficie de Li(100). El desplazamiento hacia abajo de la banda de conducción de PEO después de la formación de complejos con Li indica que Li adicional facilita la transferencia de electrones desde la superficie de Li a PEO. Esto se verifica por las tarifas calculadas para PEO. Inicialmente, PEO lleva cualquier carga cero en una capa de vacío. Después de la adsorción en la superficie de Li, gana electrones de la superficie de Li, lo que da como resultado una carga de Bader de 0,56 | mi | para PEO. Además, cuando forma un complejo con Li, muestra una mayor tendencia a recibir electrones de la superficie de Li, lo que da como resultado una carga de Bader de -0,74 | mi | para PEO. Dado que el complejo PEO-Li tiene una banda de baja conductividad, el complejo exhibe una mayor reactividad que el oligómero de PEO puro y sufre hidrólisis reductora durante las simulaciones AIMD.
Sin embargo, la naturaleza del exceso de átomos de litio sigue sin estar clara. Por lo tanto, reemplazamos el átomo de litio adicional con un ion de litio adicional, formando PEO-Li+ Un ion complejo adsorbido en la superficie de Li(100), como se muestra en la Fig. S5a. Encontramos que las estructuras de PEO-Li y PEO-Li+ Eran casi idénticos cuando se adsorbieron en una superficie de Li(100). Geometría de PEO-Li @ Li(100) y PEO-Li+ Los sistemas @Li(100) están representados por los modelos de bola y palo negro y rojo, respectivamente, en la Fig. S5b. Además, el costo de Bader calculado para PEO es – 0.74 | mi | y – 0,67 | mi | en PEO-Li@Li(100) y PEO-Li+ @ Li(100) sistema en una fila. El Li adicional en ambos sistemas muestra una carga de Bader de +0,88 | mi | , indicando su carácter de iones de litio. Esto indica que el Li adicional transfiere inmediatamente electrones a la cadena de PEO, formando iones de Li y exceso de electrones. La formación de complejos de iones de litio con PEO reduce la energía de la banda de conducción de PEO, mientras que el exceso de electrones llena la banda de conducción inferior de PEO. Aunque PEO-Li+ El sistema @Li(100) tiene una carga positiva y el PEO aún recibe electrones de la superficie de Li, donde el ánodo de metal de litio actúa como fuente de electrones. Por lo tanto, el efecto del electrón adicional es insignificante. El papel de los átomos de Li coordinados en electrolitos líquidos se ha estudiado ampliamente en estudios computacionales.33Y3435, y estos resultados también son aplicables a electrolitos poliméricos sólidos. Dado esto, el enfoque de simulación utilizado en este estudio también se puede aplicar al modelo de descomposición interfacial en baterías de metal de litio de estado sólido, donde los iones de litio y los electrones migran a la superficie del ánodo a través del electrolito y los circuitos externos, respectivamente. Los procesos del complejo PEO-Li y la transferencia de exceso de electrones al PEO son esenciales tanto en la deposición de Li como en la carga de baterías de Li-metal.

“Defensor de la Web. Geek de la comida galardonado. Incapaz de escribir con guantes de boxeo puestos. Apasionado jugador”.

